 目前公認最具發展潛力的「低侵入式診斷作法」,是利用生物晶片對病患抽出的血液進行「液態病理切片」的檢測。(圖/種子發)
目前公認最具發展潛力的「低侵入式診斷作法」,是利用生物晶片對病患抽出的血液進行「液態病理切片」的檢測。(圖/種子發)
根據衛生福利部的統計,自民國71年起到106年的國人主要死因,惡性腫瘤(癌症)已經連續36年高居首位,罹患癌症死亡的比率也逐年攀升。以普遍的癌症治療法為例,當發現有腫瘤後,除了可藉由外科手術切除外,通常還必須搭配放射線、化學、標靶治療或免疫療法等手段,採取一系列長期的治療程序。
而針對這些治療前 ∕ 後的療效評估,或癌症復發的嚴密監控,傳統都是透過「侵入式組織切片」方法取得檢體作為主要診斷根據。但並非所有病患都適合侵入性的採檢方式,例如病情嚴重及年齡較高的病患,或術後病人的復原狀況不佳等,不允許進行穿刺或手術切片,如此會造成病情監控上的限制。
若無法進行組織切片,可藉由臨床生物標誌物或醫學影像(包括超音波、磁振造影、正子造影、電腦斷層掃描)等技術來輔助,追蹤及診斷癌症病患的病情。但臨床生物標誌物會因外在干擾而影響準確性,靈敏度也有一定的限制;醫學影像技術有造成副作用、醫療費用昂貴、檢測靈敏度不高(腫瘤大小~5 mm)、判讀錯誤等不利因素。
近幾年外界推廣的低劑量電腦斷層掃描,可以早期篩檢2 mm以下的結節。只是這項技術提供的資訊仍是影像,雖然可依循結節的外形、密度、大小等分析,但並非完整的病理檢查結果,而這個技術仍可能有因為放射線引起癌變的副作用。
除了上述醫學影像技術的診斷方法外,目前公認最具發展潛力的「低侵入式診斷作法」,就是利用生物晶片當作癌症的糾察隊,對病患抽出的血液進行「液態病理切片」的檢測。這個方法除了不會產生副作用的風險外,還可提升偵測的靈敏度及檢查頻率,甚至提供基因突變的訊息,幫助醫生有效掌握癌症病患的病情發展,以及追蹤患者對各種療程的反應等。
癌症糾察隊——液態病理切片
在癌症病患血液中,有腫瘤釋放出來到周邊血液中的腫瘤游離核酸、循環腫瘤細胞及胞外泌體3種重要基因訊息,但是過去沒有適合的工具偵測這些源自腫瘤的生物訊息。現在有種新技術可以揪出這些蛛絲馬跡,就是所稱的「液態病理切片」(可比喻是具有極高戰鬥力的糾察隊)。
這些在周邊血液中的液態切片訊息非常微量,但帶有的突變證物可替代傳統腫瘤切片作為癌症預後指標,甚至後續可提供病患關於個人化的基因定序、細胞治療或藥物篩選等綜合性評估。隨著科技醫療的進步,目前生物晶片的技術能針對10毫升以下的血液,在短時間內從1011個紅血球、106至108個白血球及108個血小板的血液中,有效分離出微量的腫瘤游離核酸、胞外泌體,或少至5~10個的循環腫瘤細胞。
在這3種重要基因訊息中,「腫瘤游離核酸」是非常小片段的DNA,半衰期可短至2小時,因此能夠即時反映出腫瘤的動態變化及異質性。另外「胞外泌體」是癌細胞分泌到細胞外的微小囊泡,由直徑約為30至100奈米的雙層脂膜所構成,內部可攜帶許多不同的癌症訊息(如核酸、蛋白質、胺基酸、細胞代謝物等),並能扮演細胞間訊息傳遞的角色及布置腫瘤轉移前的微環境,這對癌轉移的趨性有非常大的影響。
「循環腫瘤細胞」是從原位腫瘤剝離進入血液循環系統的細胞,它的細胞核內有癌細胞特徵的遺傳基因或蛋白質訊息。所發展的生物晶片平台若能捕捉到這些微量的細胞,可提供癌細胞增殖、代謝、血管新生、發炎、轉移、藥物抵抗性等精準醫療的大數據。
近幾年在醫學上也已實行這液態病理切片概念,例如從懷孕的母親血液中分離出極少量源自胎兒的循環滋胚層細胞或游離核酸,以低侵入性的抽血方式取得胎兒的遺傳資訊,有可能拓展應用來取代過去數十年來傳統的羊膜∕絨毛膜穿刺的產前診斷手段。
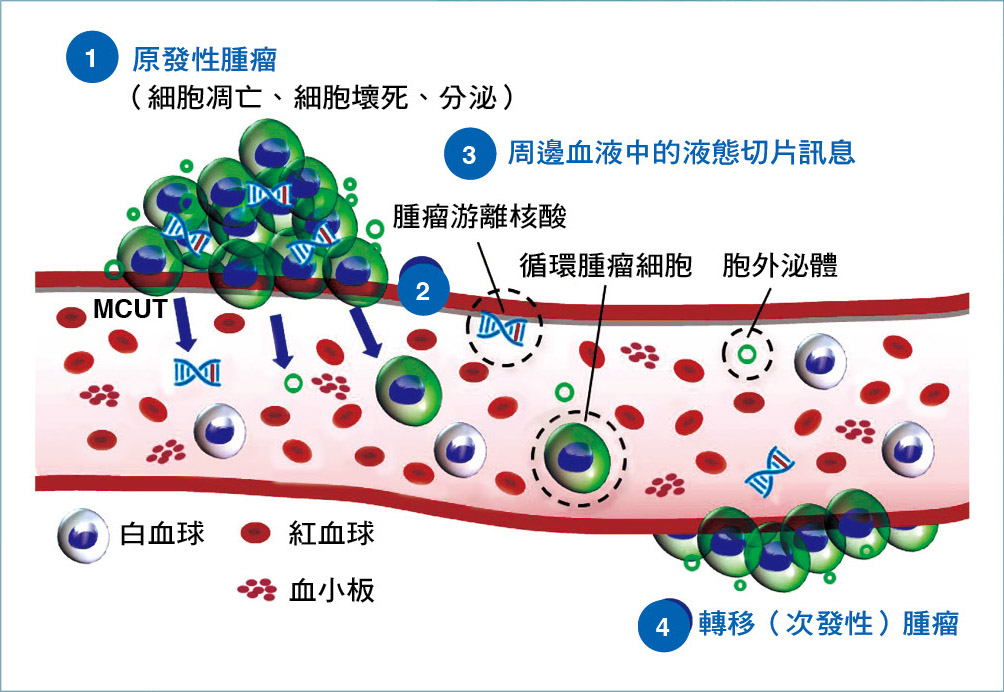 腫瘤轉移至遠處器官的4個主要階段:(1)原發性腫瘤內的癌細胞轉變成侵略性表現,其源自於細胞在細胞凋亡、壞死、分泌時所產生;(2)腫瘤游離核酸、循環腫瘤細胞、胞外泌體由原位腫瘤剝離並進入血液循環中;(3)上述3種液態切片訊息經由循環散布到遠端器官;(4)吸引循環腫瘤細胞於特定遠端組織存活,最終適應及形成遠端轉移(次發性)腫瘤。
腫瘤轉移至遠處器官的4個主要階段:(1)原發性腫瘤內的癌細胞轉變成侵略性表現,其源自於細胞在細胞凋亡、壞死、分泌時所產生;(2)腫瘤游離核酸、循環腫瘤細胞、胞外泌體由原位腫瘤剝離並進入血液循環中;(3)上述3種液態切片訊息經由循環散布到遠端器官;(4)吸引循環腫瘤細胞於特定遠端組織存活,最終適應及形成遠端轉移(次發性)腫瘤。
液態病理切片的純化法
歸納一般液態切片的純化法,對於腫瘤游離核酸的分離方式,可採取管柱萃取純化法、試劑萃取純化法、磁珠萃取純化法等。胞外泌體的分離方式,可採用超離法(以低速離心與高速離心交替進行)、磁珠萃取純化法,以及生物晶片技術進行。而循環腫瘤細胞的分離方式更多元化,且目前較常被臨床醫學所使用,因此本篇文章主要針對「循環腫瘤細胞純化」的晶片與相關技術進行技術解析。
綜合比較世界上關於「循環腫瘤細胞富集與篩選」的生物晶片技術,雖然晶片系統處於百家爭鳴的局面,大略可從「生化親和篩選」、「物理特性篩選」、「直接分析篩選」等技術方向作區分。而這3種技術差異就像是大家玩線上遊戲中的英雄角色,每位具有的能力都不同,並各有各的優缺點來對付敵人(如癌細胞)。
事實證實單一種戰鬥力無法有效抵抗惱人的癌症,如何集合眾家武功於一身,發展下一世代「系統整合篩選」的多功能晶片系統,完全表現出癌症糾察隊該有的戰鬥力,是目前許多研究機構與研發團隊需要克服的議題。以下就針對各門派的晶片系統操作概念逐項說明。
就「生化親和篩選」而言,這個技術主要是根據細胞膜上的特異性蛋白,選出適合的生物標誌物來分離細胞,而這些生物標誌物包括專一性抗體或適配體(是類似抗體的一種單鏈DNA或RNA,與癌細胞膜上的特異蛋白有很高的親和力)。一般而言,這些生物標誌物可以製作在磁珠或晶片基板表面上,根據要篩選的目標細胞(針對循環腫瘤細胞或白血球細胞),進行循環腫瘤細胞的正向篩選或白血球的負向篩選。
以磁球的篩選技術為例,藉由磁球上的生物標誌物抓住目標細胞膜上的特異性蛋白,再用磁力把黏有細胞的磁球移除。簡單來說,這種篩選概念就像在挑揀黑白棋中的黑子,若挑出黑棋子定義為正向篩選,移除掉白棋就是負向篩選,而這也算是另一種純化與篩選方式。
就「物理特性篩選」而言,早期技術可憑藉癌細胞與其他細胞間的密度差異,由密度梯度離心方式就可提供大量血液純化採樣。它的原理是利用循環腫瘤細胞較其他白血球與紅血球的密度小的關係,以低成本且操作簡單的方式分離出循環腫瘤細胞。而這個技術的缺點是會因為循環腫瘤細胞本身的異質性,造成分離出的目標細胞純度較差,導致不利下游的基因分析與檢測。
早期的另一種技術是經由細胞的尺寸大小 / 變形性方式,進行簡易且快速的細胞篩選。它的原理是利用循環腫瘤細胞具有較大的細胞直徑(約10~20 µm),而其他白血球與紅血球的直徑約為7~12 µm的物理特性,使液態切片通過孔洞直徑約為10 µm附近的濾網時,尺寸較大的循環腫瘤細胞因為其變形性不及其他血球細胞,最終卡在濾網的洞口,達到細胞純化與篩選的功用。
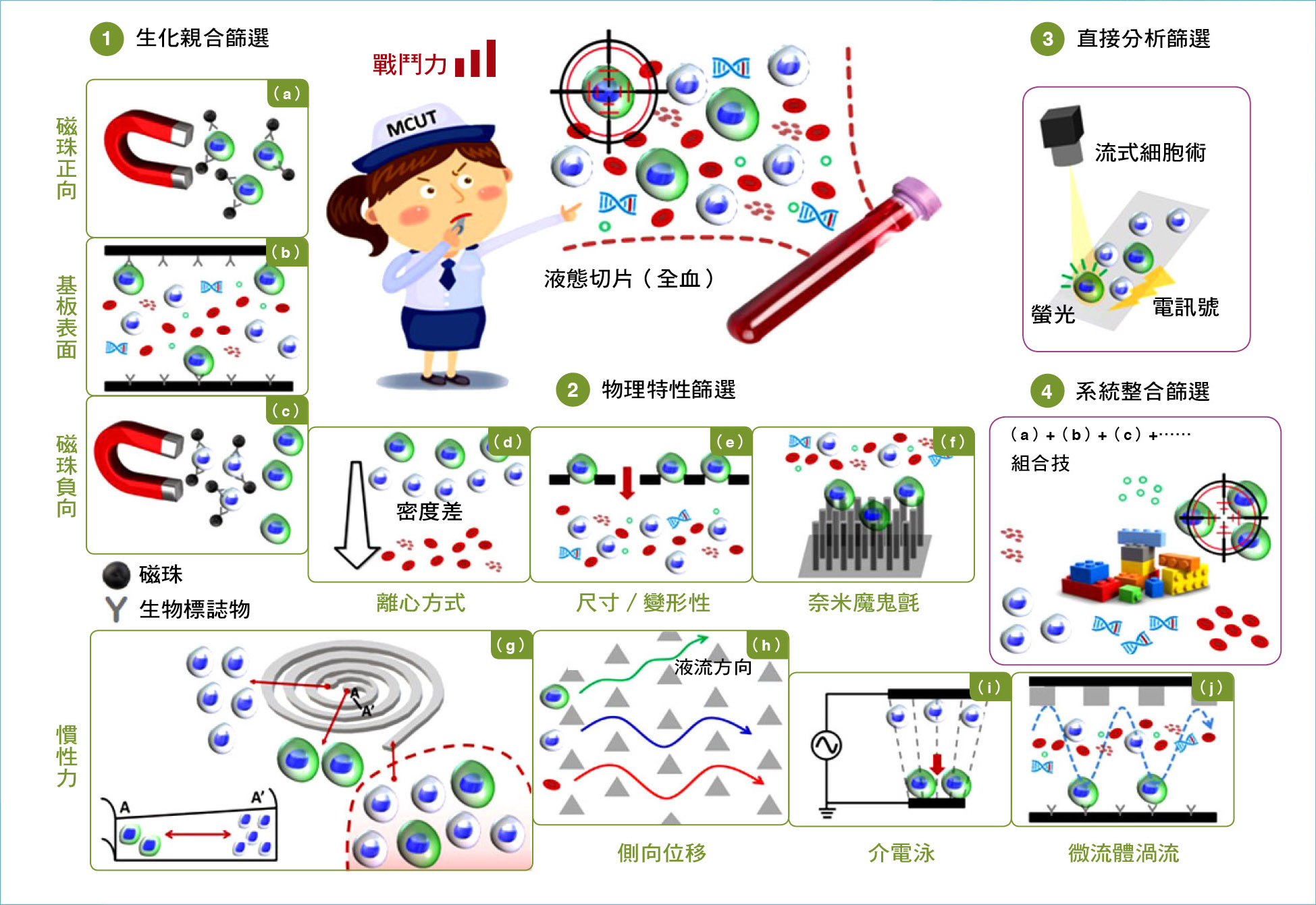 液態病理切片的生物晶片技術概述。第一類 / 生化親合篩選:(a)磁珠正向、(b)基板表面、(c)磁珠負向;第二類 ∕ 物理特性篩選:(d)密度梯度離心、(e)尺寸 ∕ 變形性、(f)奈米魔鬼氈、(g)慣性力、(h)側向位移、(i)介電泳效應、(j)微流體渦流;第三類 ∕ 直接分析篩選;第四類∕系統整合式篩選:集合以上各家武功於一身。
液態病理切片的生物晶片技術概述。第一類 / 生化親合篩選:(a)磁珠正向、(b)基板表面、(c)磁珠負向;第二類 ∕ 物理特性篩選:(d)密度梯度離心、(e)尺寸 ∕ 變形性、(f)奈米魔鬼氈、(g)慣性力、(h)側向位移、(i)介電泳效應、(j)微流體渦流;第三類 ∕ 直接分析篩選;第四類∕系統整合式篩選:集合以上各家武功於一身。
簡單來說,這種篩選概念就像是捕魚所用的漁網,會設計漁網的網格大小使小的魚苗通過,而尺寸較大的成魚才能被捕獲的概念。當然,這種技術潛在的缺點主要來自於癌細胞和白血球有尺寸重疊的問題,因此循環腫瘤細胞有可能通過濾網或微柱的間隔而漏掉,造成篩選效率上的損失。值得注意的是,其他物理特性篩選多半建構在微流體的科學技術上,主要是在微奈米尺度空間中能精確控制和操控流體(在這裡就是液態切片檢體)。
以物理特性的奈米魔鬼氈技術為例,在微流體的基板上若製作某些特殊的奈米結構,有機會增加循環腫瘤細胞與基板的交互作用,進而使循環腫瘤細胞在短時間內(<1小時)貼附在奈米結構基板上。它的原理主要是癌細胞相較於正常細胞有較長的表面絨毛結構,當癌細胞接觸到奈米結構的表面時,它的絨毛會陷入奈米結構中而糾纏在一起。
這種篩選概念就像包便當使用的魔鬼氈束帶,癌細胞表面就如同魔鬼氈一面的鉤狀結構,奈米結構則像是魔鬼氈另一面平軟的環狀結構,當其間有作用力造成接觸時,鉤與環會結合形成緊固的狀態。近期研究證實,當在奈米結構基板表面再接上生物標誌物時,物理特性加上生化親和篩選展現了1+1大於2的癌細胞捕捉效率,遠比單純奈米結構或單純生化親合篩選的能力佳。
經由這種「奈米結構」及「生化親和」的協同作用,若再搭配微流體渦流的功能,造成液態切片在晶片中的行經路徑從直線運行變成左拐右彎,可有效提升癌細胞與奈米魔鬼氈的碰撞頻率,使這類生物晶片表現優異,具有超過90%的癌細胞捕捉效率。
以另一種物理特性的慣性力技術為例,生物晶片內設計有單螺旋通道,能提供梯度剪切與管壁效應兩種慣性力。若在單一通道入口處注入液態切片檢體(包括微量腫瘤細胞與眾多白血球),經過旋轉慣性力的效應後,通道出口端靠近外側的出口會收集到尺寸較小的白血球,在靠近內側出口的地方則有機會收集到尺寸較大的微量循環腫瘤細胞。這種篩選概念就像去水上樂園玩的迴旋式滑水道,若爸爸帶3位小朋友同時從入口端滑下,慣性力會使3位小朋友出現在外側出口端,而爸爸會從內側的滑水道出口滑出來。
另一種細胞力學的篩選概念是側向位移技術。原理是在晶片通道中設計相對於流體流動方向呈一定角度或幾何構造的微柱陣列,使尺寸大的循環腫瘤細胞會發生側向位移朝向一側流出,尺寸小的其他血球則會按原流體的流動方向移動,憑藉的是尺寸不同的細胞在流動過程中呈現不同的運動軌跡。
若在晶片通道中設計兩個出口,這種技術就有機會純化並收集到微量的癌細胞。這種篩選概念就像去夜市打的彈珠台,若是有大小兩種彈珠,會發現大彈珠偏向集中落到邊緣的區域,而小彈珠匯聚到彈珠台中間的地方。雖然上述兩種物理方式可有效降低晶片篩選的成本及時間,以及提升篩選後細胞的存活率,但是因為現時的人體血液中的生物異質性較大,因此這類技術常導致癌細胞捕捉效率偏低,或常有堵塞的問題產生。
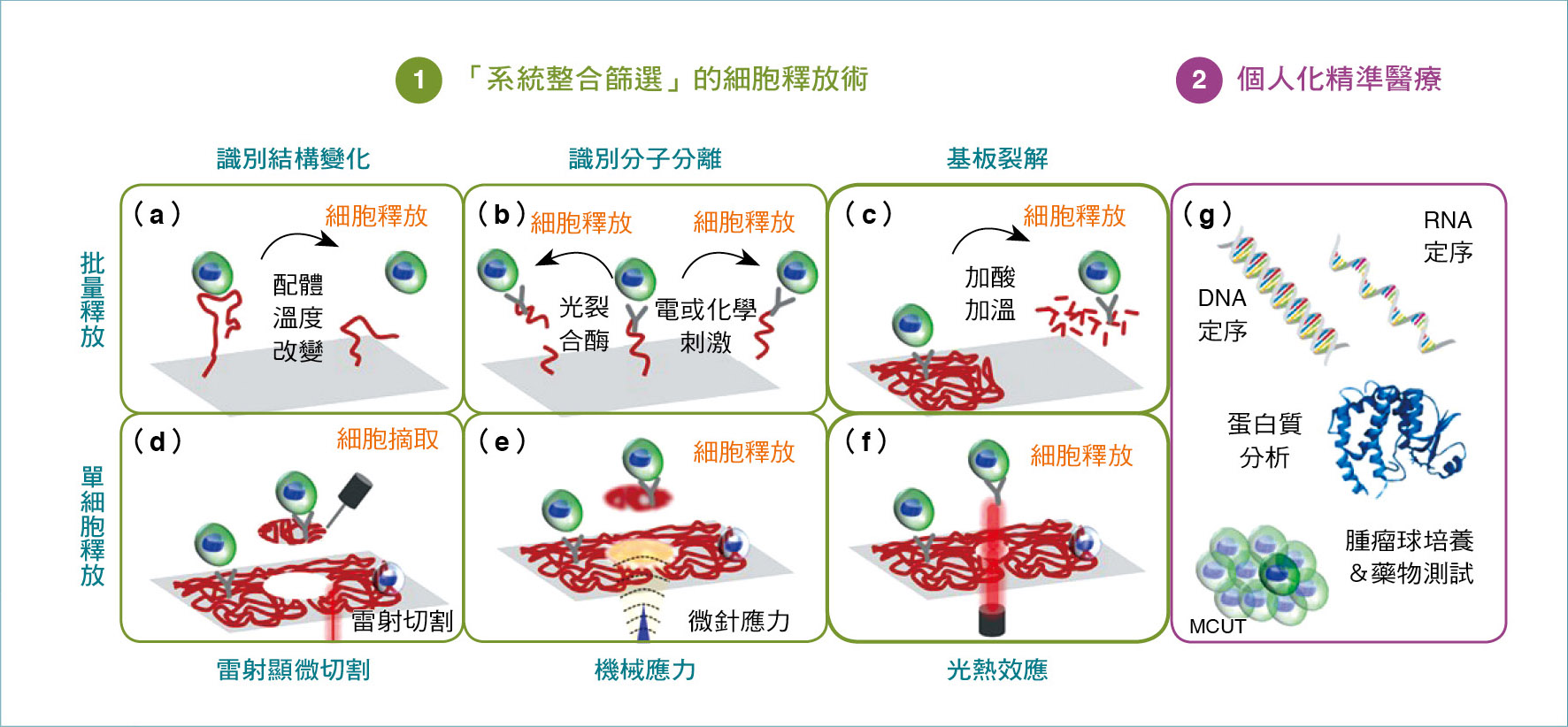 目前「系統整合篩選」生物晶片的循環腫瘤細胞釋放術,以及個人化精準醫療的示意圖。
目前「系統整合篩選」生物晶片的循環腫瘤細胞釋放術,以及個人化精準醫療的示意圖。
最後一種物理特性的介電泳技術,主要原理是在外加電場的條件下,使細胞帶電而懸浮,但依極化的程度不同,會順著外加電場方向排列在微晶片上。接著外加偏壓於兩端電極上,細胞便會因不均勻的電場產生不同程度的漂移運動,藉由免疫螢光染色的細胞標定循環腫瘤細胞,並以介電泳動的方式操控細胞移動或分離。這項技術可以在生物晶片中精確控制細胞位置到特定區域收集細胞,能達到很高的癌細胞捕捉純度。
這種系統的缺點是晶片系統昂貴,且需要先用磁珠對白血球進行初步的負向篩選,注入微晶片中需要耗時的細胞染色、規劃細胞收集路徑等,大大阻擾其於臨床的實際應用。簡單來說,這種篩選概念就像玩「推箱子」的電動小遊戲,必須先用細胞染色法判定要推哪些箱子(癌細胞),然後還要規劃好移動路徑,慢慢把在電極上的循環腫瘤細胞以介電泳方式一個一個移到晶片外收集細胞的區域。
關於「直接分析篩選」技術,主要原理是藉由光學或電性的量測,執行快速和大規模的循環腫瘤細胞篩選,但須建立在完整的自動控制與大數據處理的軟硬體配合。以臨床應用為例,這技術還是必須搭配螢光染色目標細胞,再透過光學元件進行影像掃描,判讀出目標細胞;或以免疫磁球協助電子元件判斷電壓受磁場下的差異性,才能對癌細胞進行大量快速分析。
這種篩選法的硬體及耗材成本門檻高,也是這個技術無法普遍的因素。簡單來說,這類方法的篩選概念就像發展一台功能強大的驗鈔機,要先在真鈔上放入防偽標誌後,才能判定沒有防偽標誌的假鈔,然後再一張一張把真假鈔分類出來。
生物晶片的未來發展
如今的「系統整合篩選」技術,除了能提供高純度、高效率及高細胞活性的循環腫瘤細胞外,如何從生物晶片上釋放已捕獲的癌細胞,甚至是提供單顆細胞釋放來分析癌細胞異質性,是「液態切片晶片技術」目前努力發展的方向。
簡單來說,當已經培養出訓練有素的癌症糾察隊,從癌症病患的血液中找出微量的循環腫瘤細胞,接下來如何開發一種高效的押送機制,以批量或單一的方式(例如,以溫度差造成識別結構變化、以光裂合酶或電化學刺激造成識別分子分離、以加熱或加酸造成基板裂解、以雷射光進行雷射顯微切割、以微針定頻率給機械應力、以基板局部照光轉換成熱能溶解的光熱效應)釋放完整無損的細胞,進行後續次世代基因定序、特異蛋白質分析、腫瘤球培養、癌症藥物測試等,對精準醫療的科技發展是很重要的一個環節。
不久的將來,若生物晶片能有效進行個人化的精準醫療分析與測試,將能大幅提升癌症病患的治療效果與病情監控品質,使癌症不再是聞之色變的絕症。
 目前公認最具發展潛力的「低侵入式診斷作法」,是利用生物晶片對病患抽出的血液進行「液態病理切片」的檢測。(圖/種子發)
目前公認最具發展潛力的「低侵入式診斷作法」,是利用生物晶片對病患抽出的血液進行「液態病理切片」的檢測。(圖/種子發) 腫瘤轉移至遠處器官的4個主要階段:(1)原發性腫瘤內的癌細胞轉變成侵略性表現,其源自於細胞在細胞凋亡、壞死、分泌時所產生;(2)腫瘤游離核酸、循環腫瘤細胞、胞外泌體由原位腫瘤剝離並進入血液循環中;(3)上述3種液態切片訊息經由循環散布到遠端器官;(4)吸引循環腫瘤細胞於特定遠端組織存活,最終適應及形成遠端轉移(次發性)腫瘤。
腫瘤轉移至遠處器官的4個主要階段:(1)原發性腫瘤內的癌細胞轉變成侵略性表現,其源自於細胞在細胞凋亡、壞死、分泌時所產生;(2)腫瘤游離核酸、循環腫瘤細胞、胞外泌體由原位腫瘤剝離並進入血液循環中;(3)上述3種液態切片訊息經由循環散布到遠端器官;(4)吸引循環腫瘤細胞於特定遠端組織存活,最終適應及形成遠端轉移(次發性)腫瘤。 液態病理切片的生物晶片技術概述。第一類 / 生化親合篩選:(a)磁珠正向、(b)基板表面、(c)磁珠負向;第二類 ∕ 物理特性篩選:(d)密度梯度離心、(e)尺寸 ∕ 變形性、(f)奈米魔鬼氈、(g)慣性力、(h)側向位移、(i)介電泳效應、(j)微流體渦流;第三類 ∕ 直接分析篩選;第四類∕系統整合式篩選:集合以上各家武功於一身。
液態病理切片的生物晶片技術概述。第一類 / 生化親合篩選:(a)磁珠正向、(b)基板表面、(c)磁珠負向;第二類 ∕ 物理特性篩選:(d)密度梯度離心、(e)尺寸 ∕ 變形性、(f)奈米魔鬼氈、(g)慣性力、(h)側向位移、(i)介電泳效應、(j)微流體渦流;第三類 ∕ 直接分析篩選;第四類∕系統整合式篩選:集合以上各家武功於一身。 目前「系統整合篩選」生物晶片的循環腫瘤細胞釋放術,以及個人化精準醫療的示意圖。
目前「系統整合篩選」生物晶片的循環腫瘤細胞釋放術,以及個人化精準醫療的示意圖。