什麼是「DNA定序」、「新世代定序技術」?
地球上所有生物的遺傳物質是核酸, 比如說每個人的每個細胞中都有23對染色體,每對染色體其中1條遺傳自爸爸,另1條遺傳自媽媽,每條染色體由去氧核糖核酸 (deoxyribose nucleic acid, DNA)所構成。每條染色體的DNA成分則是由兩條長鏈的單股DNA分子以螺旋曲線相互纏繞,而形成所謂的雙股螺旋。
以上這些現代生物醫學的重要基礎,要歸功於諾貝爾生理醫學獎得主華生(James Watson)和克里克(Francis Crick)在1953 年發現DNA的雙股螺旋結構,因此可以解釋DNA攜帶的遺傳訊息由親代遺傳至子代的現象。但是,遺傳物質如何記錄「遺傳的訊息」,使得不同的生物呈現出獨特的性狀呢?
如不同的人會有膚色、高矮、胖瘦等所謂先天的體質,僅僅知道了DNA分子會參與形成雙股螺旋的結構,不足以說明這些先天的生物表現型差異。這時就要考慮DNA分子如何攜帶遺傳訊息,以及這些遺傳訊息可能的變化。
每條單股的DNA分子是由一個接著一個的核苷酸連接所構成,然而核苷只有4種,各自帶有獨特的鹼基,腺嘌呤(adenine, A)、胞嘧啶(cytosine, C)、鳥嘌呤(guanine, G)、胸腺嘧啶 (thymine, T)。這4種帶有不同鹼基的核苷酸,在一個DNA分子上從頭到尾的線性排列組合便是所謂的「DNA序列」。因此在生物醫學文獻中,常常以含有A、T、G、C四種字母寫成的字串來表示及記錄DNA分子上的核苷酸排列組合,並以鹼基的種類A、T、G、C來代表核苷酸的種類。
 染色體上的DNA序列也就是4種鹼基的線性排列組合,構成了生物的遺傳訊息,決定了各種生物獨特的表現性狀。(圖/種子發)
染色體上的DNA序列也就是4種鹼基的線性排列組合,構成了生物的遺傳訊息,決定了各種生物獨特的表現性狀。(圖/種子發)
此外,生物學家也常用「鹼基對」作為雙股螺旋DNA的長度計量單位。這是因為DNA雙股螺旋中的兩條等長的DNA分子以反向互補排列,兩分子上的鹼基會配對形成分子間氫鍵:A與T配對形成兩個氫鍵,G與C配對形成三個氫鍵。染色體上的DNA序列也就是4種鹼基的線性排列組合,構成了生物的遺傳訊息,決定了各種生物獨特的表現性狀。
人類各條染色體含有的DNA分子,是由數千萬,甚至是數億個核苷酸連接而成的長鏈分子。而人類單套基因體的總長度,也就是23條染色體DNA雙股螺旋的總長度,共約為3 ×109個鹼基對。而人與人之間的的染色體DNA序列,其中99%是相同的,只有1%的相異,然而這「1%」就是決定每個人獨特性的關鍵。
有時候這「1%的相異」也許是好處,讓你有比別人厲害的潛能,但有時候卻是一件不幸的事,比如說造成某些人的先天性疾病。例如鐮刀形貧血症患者,就是因為血紅素的基因上帶有單鹼基的變異 (在HBB基因的第六個密碼子位置,患者是 GTG、正常人是GAG),使轉譯出來的血紅素蛋白異於常人,鐮刀形貧血症患者的紅血球在低氧狀況下,會變成堅硬的鐮刀型,導致紅血球容易破裂產生貧血症狀。
在生物醫學的發展上,找出造成疾病的DNA片段,並且定出其序列上與正常人的差異處,是重要的醫學研究目的之一。用來「讀取」DNA片段序列的實驗,統稱為「定序」。在媒體報導中所謂對某種生物「破解遺傳密碼」,其實通常指的是以「定序法」讀取染色體含有的「DNA序列」,也就是A、T、G、C 4種鹼基在染色體上的排列組合。一個物種的所有染色體因為包含了所有「基因」的資訊,在生醫文獻中常統稱為「基因體」,相關的學術研究也常稱為「基因體學」。
對DNA分子定序,不是一件簡單的事。因為DNA分子上的各個鹼基無法以肉眼甚至是電子顯微鏡技術加以區辨,必須利用特別設計的實驗方法,才能「觀察」到一個DNA分子上各種鹼基的排列組合。
DNA定序不是新穎的科技,早在 1975 年,諾貝爾獎得主弗雷德里克.桑格(Frederick Sanger)就發明了第一代DNA定序技術,但是在產能上有很大的限制,在單次實驗中可以讀取的總鹼基數量相當有限。比如在一次實驗中可以獲得的一段DNA分子讀序結果,其長度不超過1,000個鹼基,而且能夠同時進行定序的DNA分子數量,也只限於數十或數百個片段。
此外,面對像人類基因體這麼長的DNA序列,還必須使用繁複的樣本準備的實驗程序。因為第一代定序法技術上的限制,使得由1991年啟動的人類基因體定序計畫,花了十多年的時間及約27億美金,才在2003年宣布完成唯一的一套人類基因體參考序列。
很顯然的,這一套人類基因體參考序列只能做為健康人的正常基因體DNA序列的代表之一,並不能直接提供關於人類疾病致病基因體變異的資訊,要破解因基因體變異造成的不同的疾病原因,及其可能的致病機制,必須另外對各種疾病病人的基因體DNA定序,才能比對病人的基因體和參考序列的不同處。
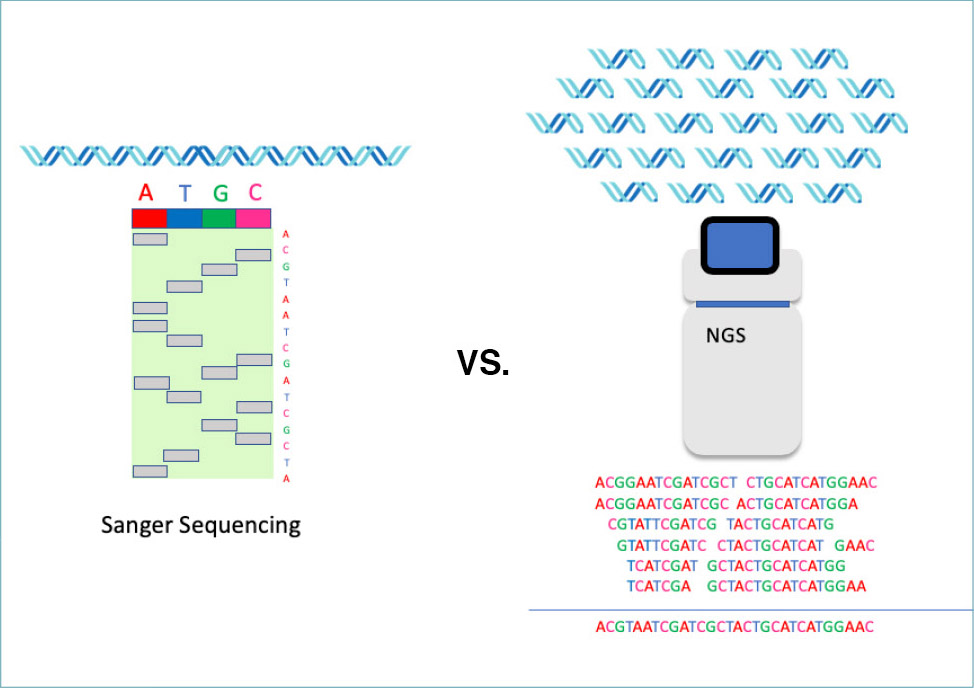 在單次實驗中,第二代定序技術可以平行地定出大量DNA片段的序列。
在單次實驗中,第二代定序技術可以平行地定出大量DNA片段的序列。
因此美國國家人類基因體研究所 (National Human Genome Research Institute, NHGRI)於2004年開始,資助學界及業界發展僅需1,000美元的人類全基因體定序技術,希望使得定序技術能夠以更低廉的價格,更廣泛地應用於各種生技研究甚至醫療應用,能夠如同過去個人電腦的平價化而促使相關科技及產業的蓬勃發展。NHGRI的努力促成了新世代定序技術(next-generation sequencing, NGS)的快速進展。
今天,使用NGS技術定序一個人的基因體序列,已經不用花費數年的時間。例如2017年1月時,全球最大的定序儀供應商推出的新款DNA定序儀器,能在2天內完成近48人的基因體定序,平均約1小時就能產出1人份的基因體序列數據。
為何新世代定序技術能達到如此高的效率呢?並不是因為它能夠定出更長的DNA片段序列,若以單一條讀序的長度來說,新世代定序技術甚至比第一代技術Sanger定序法短了許多,如讀序結果的每個片段長度不超過250個鹼基,僅有改良式的第一代定序法的四分之一。新世代定序技術的最主要優勢,在於同時進行巨量的定序反應,例如能在單次的實驗中,同時定出數百萬條甚至數千萬條長度250個鹼基的DNA序列片段。
因為新世代定序技術的快速發展,人類基因體定序的費用也不斷地下降。根據美國國家衛生研究所對歷年基因體定序成本的統計,近年來人類基因體定序費用的下降速率,甚至遠超過摩爾定律對半導體產品價格下跌趨勢的預測 。在2008年至2018年的10年間,每18個月的DNA定序的價格下降率遠超過50%。
自2017年後,決定一套人類基因體序列的費用僅約1,000美元,這意味著「定序」不再是具有雄厚財力的研究機構的專屬工具,而逐漸成為一般中產階級也可以負擔得起的「產品」。但是這種產品對我們每個人的價值是什麼呢?知道了自己的基因體DNA序列,對於我們生活的影響為何?若干生技公司看準了NGS的應用潛力,紛紛推出以高通量定序為基礎的精準醫療方案,是否與每個人都有切身的關係呢?本文後半段將討論新世代定序在未來重要的應用趨勢之一:精準醫療。
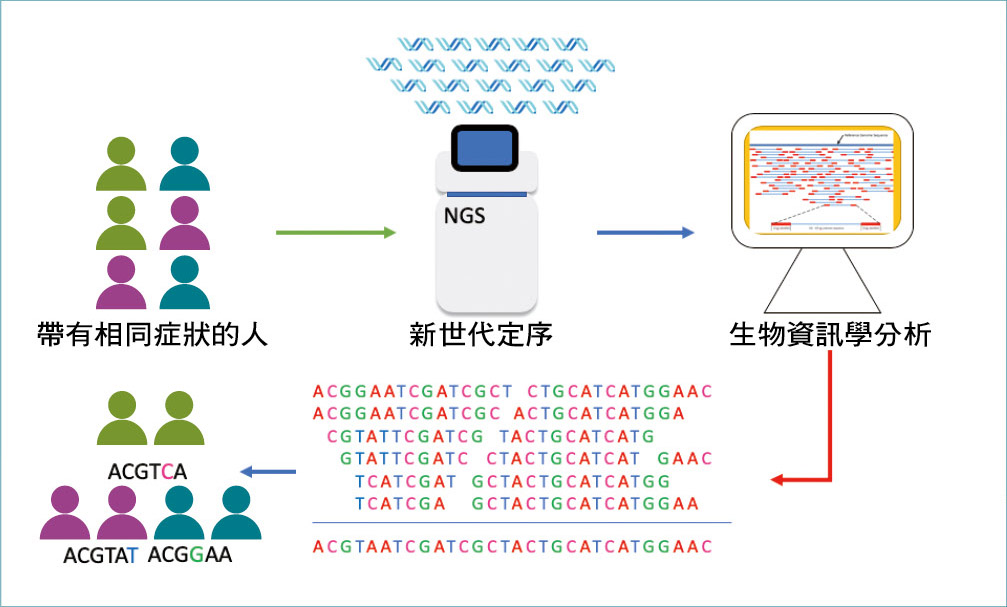 新世代定序技術可以在短時間內找出眾多疾病患者的基因體變異位點,有助於精準醫療的實踐。
新世代定序技術可以在短時間內找出眾多疾病患者的基因體變異位點,有助於精準醫療的實踐。
精準癌症醫療:分析癌細胞基因體變異,找到最適合的治療方式
因為醫學的發展,使得現代人的健康大為改善,最明顯的例證是人類平均壽命的延長。比如在19世紀初,全球各地平均壽命不超過40歲,到了21世紀的今日,全世界有近30個國家的人口預期壽命超過80歲。
但是醫學昌明的今日,依然有不少類型的疾病在治療上遭遇很大的困難,特別是癌症,療法失效的比率甚至高達7成以上。近年來雖然有抗癌免疫療法的突破性發展,在某些癌症的治療上達到了長期持續性的療效,帶給癌症病患前所未有的希望。另一方面,不同癌症種類的治療效果並不一致,最多只有百分之二十左右的病患呈現療效。
癌症成長的趨勢令人吃驚,罹癌人數不斷攀升,這是一個全球面臨的公衛危機。世界衛生組織於2018年9月公布報告指出,全球一年將新增1,800萬起癌症病例,其中960萬人會死於癌症。男性每5人就有1人罹癌,女性是每6人就有1人可能罹患癌症。國民健康署統計結果顯示,自2016年後,台灣每年新增加10萬名癌症病患,平均每5分鐘不到就有1人罹癌。罹癌患者年輕化是另一個警訊,平均每10位癌症患者中,就有1名是20歲至44歲的青年。
近年來研究癌症治療的重要趨勢之一,是利用新世代定序技術分析癌細胞的基因體變異,找出不同病患的癌症惡化因子,以選擇最適合的治療方式,達到最佳的治療效果。以上便是把精準醫療的基本理念應用於癌症研究,又稱精準癌症醫療。
乍聽之下,似乎是個新穎的觀念,但是其實類似的想法在近2,000年前中國古代便已產生。相傳東漢時代的華佗善於辨別病因,對於具有相同症狀但病因不同的病人,會視情況施以不同的治療來達到最好的療效。後人便依此發明了「對症下藥」的成語,一方面讚美華佗的醫術,另一方面則強調,欲解決問題應深入探索造成問題的原因,切勿只是症狀上的一時解決。
現代精準醫療的興起,則是於2015年1月美國前總統歐巴馬在國情咨文演講中提出「精準醫療啟動」計畫(Precision Medicine Initiative)。其總經費約2億美元,其中3分之2用來建立百萬人的醫療紀錄、基因、生活習慣等數據資料庫,還有法規的建立,以及保護隱私與個資安全的機制;近3分之1(7,000萬美元)則用於癌症基因變異研究及其新藥開發。
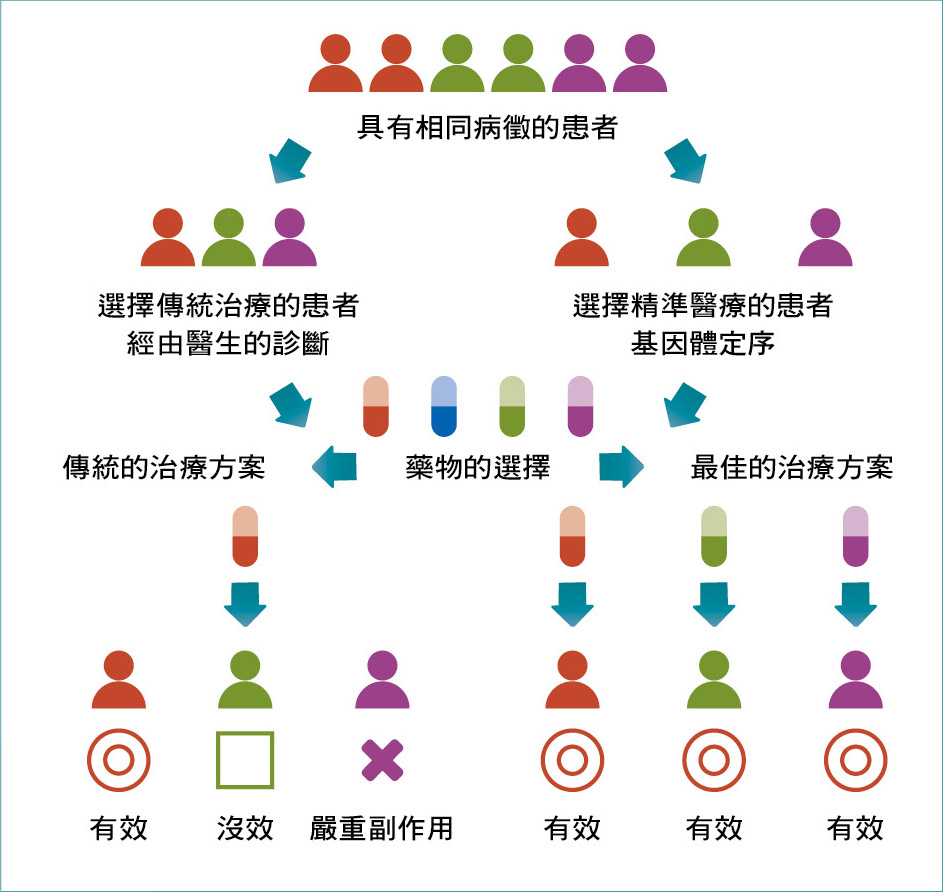 現代精準醫療的核心策略─偵測病人的基因體變異位點,把病人分群,分別施以適合各亞群的治療方案。
現代精準醫療的核心策略─偵測病人的基因體變異位點,把病人分群,分別施以適合各亞群的治療方案。
精準醫療的核心目標之一,就是針對各種疾病,特別是癌症,尋找其病變細胞所具有的基因變異,並且由其中區辨出「可採取治療措施」的特定基因變異。乍看之下這似乎是很深奧的術語,但是實際上所指的就是對已知的標靶藥物會有反應的特定基因的變異。
舉例而言,基因變異的類型對非小細胞肺癌治療方法的選擇有很大的影響。例如癌細胞的上皮生長因子受體 (EGFR)的基因,若是具有特定的基因序列的突變類型,則可以選擇最適合的標靶藥物,以抑制這類異常的EGFR的功能。又如肺癌病人的細胞若具有ALK-EML4融合基因,則可以另外選用標靶藥物抑制其功能。
具有變異的特定基因的功能,若被標靶藥物抑制,為何就能抑制癌細胞的生長,甚至達到治療並延長病人存活時間的效果呢?這是因為以上這些基因變異的例子,就是所謂的「驅動突變」,比如說變異的上皮生長因子受體可以使得細胞在沒有外界的生長因子刺激時,自行活化發出促進細胞生長的訊號,使得癌細胞具有不斷生長的能力。以標靶藥物抑制具有「驅動突變」的特定基因的功能,比起非專一性的療法如化療,可以達到更好的癌症治療效果。
有愈來愈多的實例顯示,癌症的治療不再是只有少數標準療法,對具有相同症狀的病人施以相同的藥物,而是走向精準的癌症醫療,對病人的癌組織進行全基因體或若干已有標靶藥物治療的致癌基因進行DNA定序,因此可以把相同症狀的病人,依其所帶有的基因變異種類分成不同的病人亞群,對不同的亞群分別投以適當的標靶藥物。精準醫療的實踐就是:DNA定序、病人分群、標靶藥物。
要達到精準醫療的目的,甚至是進一步的個人化醫療,還有一段漫長的路要走。在人類基因體定序計畫即將完成之時,現任美國國立衛生研究院院長Francis Collins 發表了〈人類基因體計畫的醫學和社會意義〉一文(N. Engl. J. Med. 1999, 341:28–37),他認為因為人類基因體序列的解讀,將揭示各種疾病的遺傳因子,並且預期在15年至20年內,會看到治療藥物的徹底轉變。
但是迄今為止,癌症精準醫療的效果並未能真正地達到理想的境界,標靶治療仍有其極限。最大的問題有二:其一是抗藥性的產生,其二是已有的標靶藥物並未能適用於所有的病人。
精準醫療的未來發展方向:以大量快速的定序尋找癌症病患都有的基因變異
癌症是一種高度異質性的疾病,具有同類癌症的不同病人,其「驅動突變」可能有所不同,如不同的病患可能帶有不同的變異基因,或不同的病患在同一個基因但是不同的位點突變。也就是說,對一位癌症病患有效的標靶藥物,用到另一位具有同一種癌症的患者,不見得能夠抑制其驅動癌症惡化的基因變異。因此,癌症精準醫療的理想實踐方式,是依照病人癌細胞所帶有「可採取治療措施」的特定基因變異,選擇適當的標靶藥物治療。
 癌症精準醫療的理想實踐方式,是依照病人癌細胞所帶有的特定基因變異,選擇適當的標靶藥物治療。(圖/Pixabay)
癌症精準醫療的理想實踐方式,是依照病人癌細胞所帶有的特定基因變異,選擇適當的標靶藥物治療。(圖/Pixabay)
研發一種新穎的抗癌藥物通常要花費數年時間,對於全世界快速增長的癌症病例緩不濟急。因此,近年來精準癌症醫療的發展重點,並不是盡全力開發新穎的抗癌標靶藥物,而是建立在已有的抗癌藥物基礎上,更廣泛地邀請更多的癌症病患進行臨床試驗,評估各種「可採取治療措施」的基因變異對於已有的各種標靶治療的反應,以及癌細胞的生長是否能有效地抑制。
其中重要的發展方向之一,就是尋找不同種類癌症的病患可能都有的「可採取治療措施」的基因變異,以評估特定標靶藥物的療效。未來的精準癌症醫療很可能不會再根據發生癌症的組織器官,如肝癌、肺癌等,來選擇治療藥物。
很明顯的,在精準醫療的發展中,新世代定序技術扮演重要的角色。其高通量產能——在1~2天內就可以定出1個人的全基因體序列,有助於研究人員蒐集更多、具有潛力的「可採取治療措施」的基因變異,藉以測試已有的標靶藥物的效果,或另行開發新穎的標靶藥物。
已有許多國家積極投入推動精準醫療研究,最快啟動精準醫療行動的是英國在2013年宣布的「十萬人定序計畫」。美國在2015年前總統歐巴馬宣布「精準醫療啟動」計畫,要邀請100萬名美國人進行其基因體的定序。中國大陸在2016年「國家重點研發計畫」中把啟動精準醫療作為最優先的項目。台灣也於2012年啟動「人體生物資料庫」計畫,已蒐集了超過10萬名自願者的各種人體生物樣本及資料。深切地盼望,精準醫療的發展可以進一步地提升全民健康的照護,達成更好的醫療效果。
 染色體上的DNA序列也就是4種鹼基的線性排列組合,構成了生物的遺傳訊息,決定了各種生物獨特的表現性狀。(圖/種子發)
染色體上的DNA序列也就是4種鹼基的線性排列組合,構成了生物的遺傳訊息,決定了各種生物獨特的表現性狀。(圖/種子發) 在單次實驗中,第二代定序技術可以平行地定出大量DNA片段的序列。
在單次實驗中,第二代定序技術可以平行地定出大量DNA片段的序列。 新世代定序技術可以在短時間內找出眾多疾病患者的基因體變異位點,有助於精準醫療的實踐。
新世代定序技術可以在短時間內找出眾多疾病患者的基因體變異位點,有助於精準醫療的實踐。 現代精準醫療的核心策略─偵測病人的基因體變異位點,把病人分群,分別施以適合各亞群的治療方案。
現代精準醫療的核心策略─偵測病人的基因體變異位點,把病人分群,分別施以適合各亞群的治療方案。 癌症精準醫療的理想實踐方式,是依照病人癌細胞所帶有的特定基因變異,選擇適當的標靶藥物治療。(圖/Pixabay)
癌症精準醫療的理想實踐方式,是依照病人癌細胞所帶有的特定基因變異,選擇適當的標靶藥物治療。(圖/Pixabay)