 (圖/Tessa Rampersad,Unsplash)
(圖/Tessa Rampersad,Unsplash)
「阿茲海默症失智患者來到診間接受醫生診斷時,頭腦已經受到物理變化損傷,所有的臨床治療只能延緩退化,沒辦法根治。」白明奇解釋,阿茲海默失智者就醫時,所有病變都已經發生,要治療已經來不及。
年紀與遺傳是失智症主因
根據衛生福利部統計,台灣粗估的失智者人口將近30萬人,其中80歲以上的老人,每五人就有一位是失智者。台灣失智症協會更推估,台灣到了民國120年,每100人就有二位失智者。
失智症的種類多元,其中最常見的即是阿茲海默症。1901年德國精神科醫師愛羅斯‧阿茲海默(Alois Alzheimer),清楚地描述了第一個阿茲海默症案例的臨床表現與病理的變化,包含幻覺、妄想、血管硬化等。但100多年後的今日,即使醫學技術日新月異,醫界仍無法有效治療阿茲海默症。
 阿茲海默症患者初期會出現記憶力衰退,對時間、地點和人物的辨認有問題。(圖/白明奇提供,董容慈重新製作)
阿茲海默症患者初期會出現記憶力衰退,對時間、地點和人物的辨認有問題。(圖/白明奇提供,董容慈重新製作)
白明奇解釋,導致阿茲海默症的危險因子相當多,年紀與家族遺傳史是最主要的原因,缺乏運動、心血管疾病、慢性病也可能會加速病情惡化。失智症患者是不是真的越來越多?他說,台灣人平均壽命增加,「年齡」這項造成阿茲海默症主要因素也被拉高,相對就提高了失智症的發生機率。
海馬迴與內嗅皮質主宰記憶
阿茲海默症的症狀包含記憶力、語言功能喪失,以及妄想、幻聽、幻視,到最終失去生活自主能力;在病理特徵中最重要的即是「海馬迴」受損;同時,失智者的腦部可見大量的類澱粉蛋白堆積。但這些病理現象,都是解剖後才能發現。海馬迴在太陽穴垂直深入腦內大約6、7公分、因為形狀類似海馬而得名。
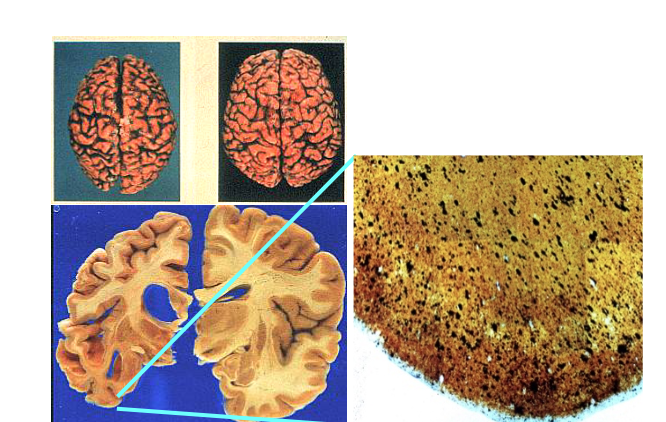 (左上圖)左邊是阿茲海默症病人的大腦,腦部白質嚴重萎縮,灰質(即神經細胞)大量死亡,細胞跟細胞之間的連結也變得稀疏,導致訊息不能傳遞。(左下、右圖)腦部放大解剖的黑色部分就是老化斑塊,裡面隱藏的即是類澱粉蛋白。(圖/白明奇、郭余民提供)
(左上圖)左邊是阿茲海默症病人的大腦,腦部白質嚴重萎縮,灰質(即神經細胞)大量死亡,細胞跟細胞之間的連結也變得稀疏,導致訊息不能傳遞。(左下、右圖)腦部放大解剖的黑色部分就是老化斑塊,裡面隱藏的即是類澱粉蛋白。(圖/白明奇、郭余民提供)
「內嗅皮質」(entorhinal cortex)也是一個重要的大腦構造,它能讓個體在移動過程中確認空間定位,簡單來說,就是讓人知道自己身在何處。內嗅皮質有很多的「網格細胞」(grid cells),當「網格細胞」和海馬迴裡的「地方細胞」(place cells)合作時,就能執行很好的空間認知功能,讓個體到達想去的地方或是回到出發地點;反之,就有可能迷路。
阿茲海默症病程的極早期,就可以看到「滔蛋白」(tau protein)出現在海馬迴與內嗅皮質。滔蛋白被視為細胞受到破壞的指標,因此,這裡的腦區算是阿茲海默的上游發源地,隨著病情嚴重逐漸擴展到頂葉以及其他腦區,造成大腦功能依次敗壞。
了解內嗅皮質與海馬迴的功能,對於阿茲海默症早期症狀的偵測,有很大的助益。現在醫學家希望能夠找出有效的生物標記,來診斷失智症,最直接的方式即是「抽脊髓液」,因為類澱粉蛋白會釋放到人的腦脊髓液中,但老人家通常不願意被抽「龍骨水」。
最新的技術則是「正子攝影」,透過注射具放射性的藥劑,使這些藥劑與類澱粉斑塊結合顯影。缺點是成本高,一次檢測要花上7萬元,且這樣技術目前只用在臨床試驗與醫學研究。
用「白詹裝置」判斷認知是否有障礙
白明奇及詹劭勳共同研發檢測失智症患者的智慧裝置-「白詹裝置」,他們以成大自強校區作為實驗範圍,受測者手持電子地圖,按照指定路徑行走,累積多量參與者的樣本後,可以得出三種大致的路徑圖。
如下圖,綠色路徑是正常人持地圖行走,路徑規律且一致。紅色路徑則是阿茲海默者,即使他們已經按照地圖行走,研究團隊收集到的軌跡仍舊混亂。藍色軌跡雖尚符合地圖路徑,但開始出現迷路、走錯路的跡象,屬於開始出現輕度認知障礙的患者。
 白詹裝置的運動軌跡顯示,阿茲海默症患者的行走路線混亂。(圖/白明奇教授提供)
白詹裝置的運動軌跡顯示,阿茲海默症患者的行走路線混亂。(圖/白明奇教授提供)
白明奇解釋,主管記憶的海馬迴開始萎縮到患者真正發病,這中間大約相隔10年。病患來到來到門診時,所有病變已經到位,治療很難挽回了。白詹裝置透過受測者的行走軌跡,及早發現「未來患者」,可給予患者與家人適時的建議,延緩症狀惡化。
目前,這項研究仍停留在封閉的研究場域,白明奇的研究團隊希望可以及早進展到開放的研究場域,找出潛在的失智症患者,才好提早預防!
本著作係採用 創用 CC 姓名標示─非商業性─禁止改作 3.0 台灣 授權條款 授權.
本授權條款允許使用者重製、散布、傳輸著作,但不得為商業目的之使用,亦不得修改該著作。 使用時必須按照著作人指定的方式表彰其姓名。
閱讀授權標章或
授權條款法律文字。