根據台灣衛生福利部國民健康署公布 106 年登記資料,台灣十大癌症癌依序為大腸癌、肺癌、女性乳癌、肝癌、口腔癌、攝護腺癌、甲狀腺癌、皮膚癌、胃癌以及食道癌等癌症,這些癌症都會造成人體健康受損。世界衛生組織資料顯示癌細胞為不正常快速增生的細胞,且會擴散到周圍細胞,影響健康 。一般而言,預防比治療更重要,吃得均衡、定時運動、保持正常體重並且定期身體健康檢查才是最重要的,但萬一真的得了癌症後,如何治療?一般有外科治療、化學療法以及放射線療法等,這些治療方法都是相輔相成的,隨著科技進展,也發展出了標靶治療、免疫療法等治療方法。外科治療就是利用手術方式將癌細胞切除;放射線療法利用放射線對細胞的進行傷害;一些化學療法利用阻斷癌細胞的 DNA 複製,以消滅癌症細胞,但容易造成身體其他部位的損害。
因此,如何減少癌症化學療法副作用引起許多學者的興趣。一些相關的研究,例如:靜脈注射奈米金包矽顆粒 (Nanoshell),並搭配近紅外光照射患處,使得金包矽顆粒發熱並殺死癌細胞的方式[1](如圖一)。或是結合不同療法或藥物的雞尾酒療法可減少副作用[2],而利用修飾葉酸的奈米分子作為導引到具有葉酸受體的癌細胞上,再利用近紅外光照射患部以釋放藥物[3](如圖二),但是,由修飾葉酸的奈米顆粒除了會引導到癌症附近,也會被吸引到腎臟,因此,若能加入其他方式對藥物做引導,以精確抵達患處,便能達到更好的治療成效,如磁場引導藥物並搭配化學藥物治療。
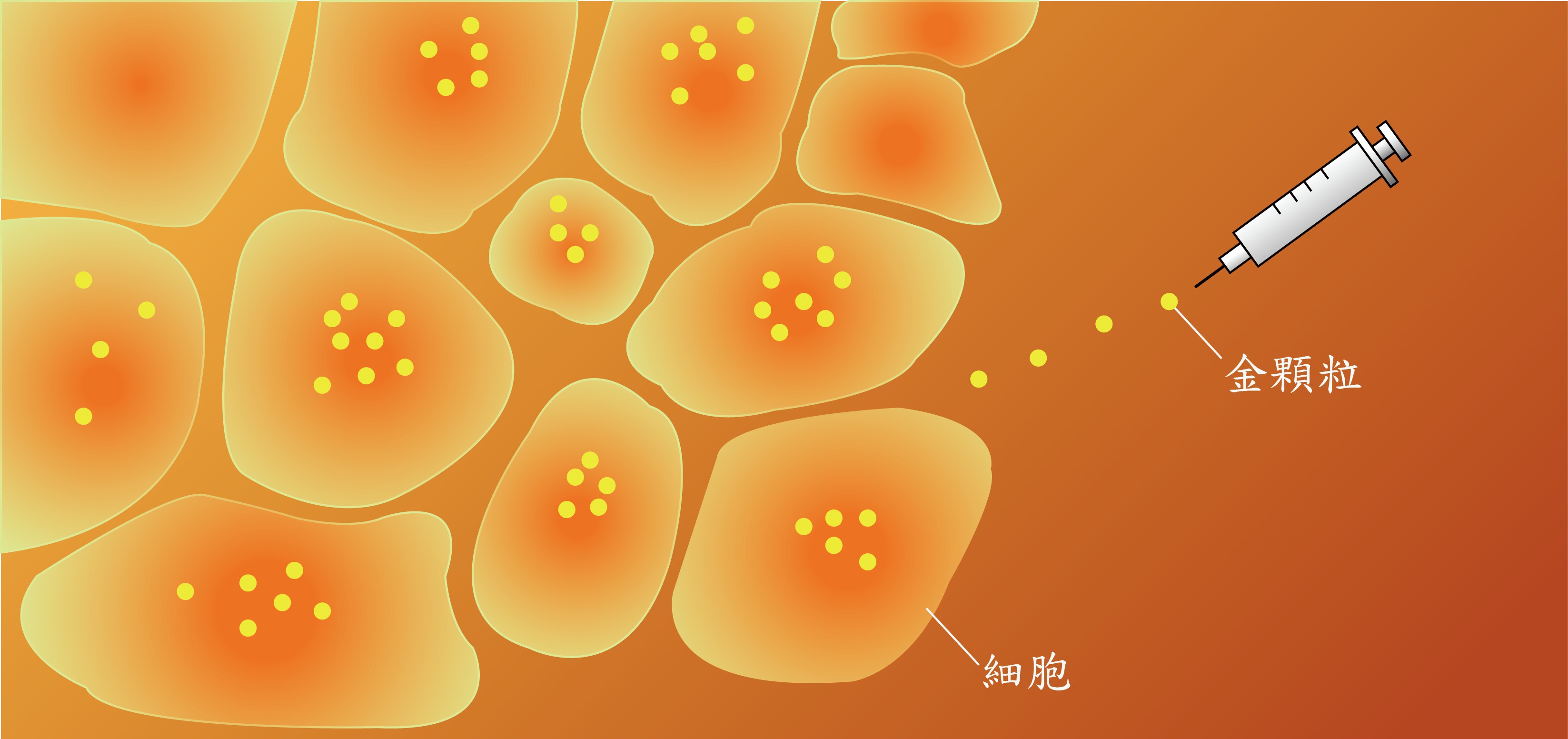
圖一:經由靜脈注射後,到達身體內部的奈米金包矽顆粒。圖中金黃色顆粒為奈米顆粒於細胞内的示意圖。圖/洪連輝教授團隊提供

圖二:奈米顆粒修飾葉酸 (folic acid) 並攜帶阿黴素藥物 (doxorubicin),folate receptor 為癌細胞上的葉酸受體,當藥物受到癌細胞吸引並抵達癌細胞位置後,經由近紅外光照射後釋放藥物[3]。圖/洪連輝教授團隊提供
本篇主要介紹有關磁引導之標靶藥物,磁引導標靶藥物結構由不同材料組成,氧化鐵做為奈米顆粒核心,將奈米顆粒核心包覆金殼層,再將金殼層外部長成多孔隙的氧化矽外層並將化學治療藥物-阿黴素 (DOX) 填入空隙中,最後利用雙螺旋去氧核糖核酸(扭成螺旋狀的 DNA)作為蓋子,將多孔隙蓋起來,阻止藥物流出[4](如圖三)。

圖三:多球殼多層奈米結構,每層結構有不同材料以及功能,將氧化鐵顆粒(綠色顆粒),包覆金殼層(圖中金黃色層),之後再長成多孔隙氧化矽(圖右上之圓形物體)並填入阿黴素(圖中紅色膠囊顆粒),最後利用雙股螺旋 DNA 將孔隙擋住防止藥物釋出[4]。圖/洪連輝教授團隊提供
作為蓋子的去氧核糖核酸有許多不同種類,可以互相嵌合組成長鏈,並扭成雙股螺旋狀態,利用此機制,將多孔隙氧化矽外層修飾可以嵌合去氧核糖核酸的化學結構,再通過結合其他不同去氧核糖核酸,扭轉成雙股螺旋組成蓋子。磁引導標靶藥物由靜脈注射後,由磁場引導至患部,再照射近紅外光(光線波長808 nm)使得金殼層產生熱量,將雙股螺旋去氧核糖核酸解開並釋放藥物,在患處作用以殺死癌細胞(如圖四)。

圖四:磁引導奈米顆粒藥物。
經由靜脈注射後,利用磁力引導,近紅外光雷射照射,使奈米顆粒生熱並解開雙股螺旋去氧核糖核酸釋放藥物[4]。圖/洪連輝教授團隊提供
其中,具鐵磁性的氧化鐵顆粒,可以作為磁振造影 (MRI) 的對比劑,輔助治療癌症前,掃描確認癌細胞位置。找出癌細胞位置的方式,可以利用電腦斷層掃描 (CT)、磁振造影 (MRI) 以及正子造影 (PET) 等方式,其中磁振造影技術可以利用對比劑 (contrast agent) 增加 MRI 影像對比成度。利用氧化鐵奈米顆粒結合光熱療法以及化學療法實驗中顯示出良好效果,由小白鼠的實驗可看到混合化學療法、磁引導的藥物實驗比控制組實驗更有效,可在 14 天內明顯的將老鼠的腫瘤細胞尺寸縮小[4]。這些研究以及實驗展示出了結合光熱療法、磁引導以及奈米顆粒技術的標靶治療方式,在人類面對疾病提供了更多的選擇,這類標靶治療可以提高人類得到癌症的存活機率,並降低藥物的副作用。
本著作係採用 創用 CC 姓名標示─非商業性─禁止改作 3.0 台灣 授權條款 授權.
本授權條款允許使用者重製、散布、傳輸著作,但不得為商業目的之使用,亦不得修改該著作。 使用時必須按照著作人指定的方式表彰其姓名。
閱讀授權標章或
授權條款法律文字。