癌症連續37年蟬聯國人十大死因之首,根據衛福部統計,2018年國人死於癌症人數已逼近5萬人,占所有死亡人數28.2%,即平均每3名往生者中,就有1人死於惡性腫瘤,可見癌症治療研究之迫切。
傳統化學藥物、手術及放射性治療等主要治療方式,雖能有效抑制癌細胞生長及擴散,但常引發許多副作用,例如免疫系統受損或噁心、食慾不振等。以傳統化學藥物治療為例,雖然含鉑的化療藥物——順鉑(Cisplatin)進入體內後可抑制癌細胞DNA的複製過程,從而殺死癌細胞,但也難免毒害到部分正常細胞;且隨著藥物使用時間增長,患者產生抗藥性,疾病便會再度復發。
近年光熱療法逐漸興起,由臺灣科技大學化學工程學系教授張家耀領導的團隊,採用光熱敏感奈米材料——銅鐵硫當吸光物質,在經過紅外光照射後,吸附於癌細胞表面的銅鐵硫會產生熱量,造成局部高溫殺死癌細胞,提升癌症治療功效。
然而,要避免殺害正常細胞,光熱敏感材料需要懂得如何辨識癌細胞。德國化學家赫爾曼・埃米爾・費歇爾(Emil Fischer)提出「鎖鑰理論」(Lock and Key Theory),認為分子和生物細胞間存在高度專一性,配體與受體就像鎖頭和鑰匙般,每種受體只能結合某些特定形狀的配體。
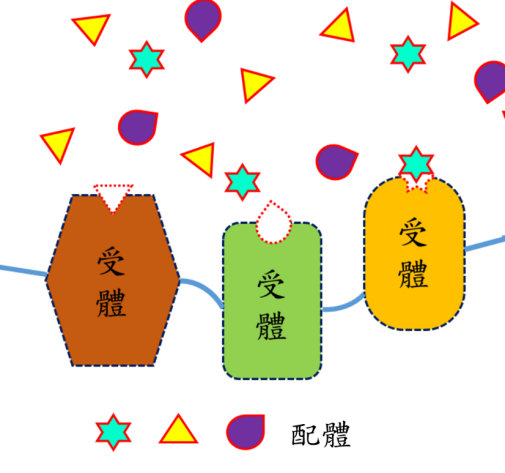 圖為配體與受體概念示意圖。配體與受體就像鎖頭和鑰匙般,每道鎖都必須利用某把特定的鑰匙才能夠打開。由於受體與配體結合並未生成共價鍵結及任何化學反應,是由分子間作用力產生,因此結合可被拆解或取代。(圖/彰師大林泱蔚教授提供)
圖為配體與受體概念示意圖。配體與受體就像鎖頭和鑰匙般,每道鎖都必須利用某把特定的鑰匙才能夠打開。由於受體與配體結合並未生成共價鍵結及任何化學反應,是由分子間作用力產生,因此結合可被拆解或取代。(圖/彰師大林泱蔚教授提供)
張家耀團隊在其製造的光熱敏感材料——銅鐵硫表面結合玻尿酸分子(配體),針對黑色素腫瘤細胞表面蛋白質(受體)結合,達到高度專一性,有效殺害癌細胞,而幾乎不影響正常細胞。
為了增強毒殺效果,張家耀團隊也將抗癌藥物順鉑用於光熱敏感性材料中。當紅外線照射,吸附於癌細胞的光熱敏感性材料便會發生光熱效應,使該癌細胞局部升溫,過程中也釋放順鉑,達到光熱治療與化學治療的加乘效果。光熱治療產生的熱量還可增進細胞代謝,促進抗癌藥物吸收。
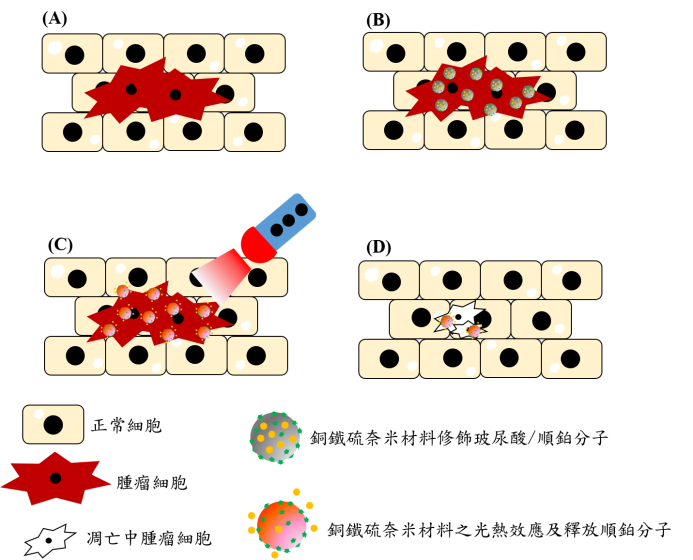 <光熱療法專殺癌細胞流程。(圖/彰師大林泱蔚教授提供)
<光熱療法專殺癌細胞流程。(圖/彰師大林泱蔚教授提供)
若光熱敏感性材料結合順鉑,即便沒有照射紅外線,藥物用量增加仍可使腫瘤細胞存活率剩50%,造成一定程度的殺傷力。若照射紅外線長達10分鐘,腫瘤細胞存活率則隨著藥物用量增加而下降至15%,顯示光熱化療相較於單獨治療,更具殺癌效果。
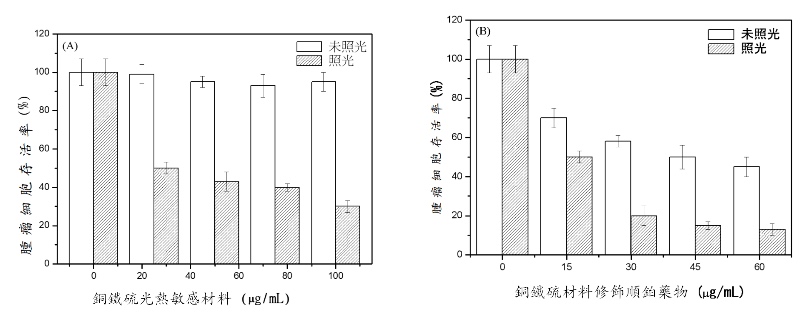 圖為未照光和照射紅外線10分鐘的狀況下,小鼠黑色素腫瘤細胞的存活率比較。(圖/臺科大張家耀教授團隊提供)
圖為未照光和照射紅外線10分鐘的狀況下,小鼠黑色素腫瘤細胞的存活率比較。(圖/臺科大張家耀教授團隊提供)
本著作係採用 創用 CC 姓名標示─非商業性─禁止改作 3.0 台灣 授權條款 授權.
本授權條款允許使用者重製、散布、傳輸著作,但不得為商業目的之使用,亦不得修改該著作。 使用時必須按照著作人指定的方式表彰其姓名。
閱讀授權標章或
授權條款法律文字。